Читать книгу - "Дальтон. Атомная теория - Enrique Joven Alvarez"
Аннотация к книге "Дальтон. Атомная теория - Enrique Joven Alvarez", которую можно читать онлайн бесплатно без регистрации
— количество вещества, образовавшегося на электроде при пропускании через электролит, прямо пропорционально количеству пропущенного электричества;
— для разных электролизных процессов при одинаковом количестве электричества, пропущенного через электролит, массы образовавшихся веществ пропорциональны их химическим эквивалентам.
В то время ничего не знали о носителе электрического заряда и об электроне как части атома.
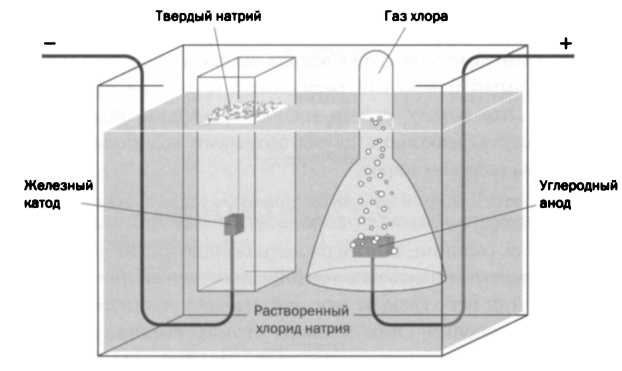
Схема электролиза
Дальтон бегло говорил по-французски и переписывался со своим другом и соперником Бертолле, причем переписка не прерывалась даже в непростой период Наполеоновских войн. Ученые не только обменялись почетными званиями в своих научных учреждениях, но и не прекращали обмена идеями, статьями, произведениями. Бертолле получил экземпляр "Новой системы химической философии" в 1808 году, через два месяца после публикации, хотя он открыто критиковал книгу и предостерегал своих коллег от опасного влияния атомной теории. Бертолле после Лавуазье был самым большим авторитетом в области химии, по крайней мере во Франции.
Великий Бертолле умер в 1822 году, в тот же год, когда он лично познакомился с Дальтоном в Аркейле. Его учеником и ассистентом был Жозеф-Луи Гей-Люссак, один из величайших химиков нашей эпохи. Гей-Люссак был неутомим и бесстрашен в своих исследованиях. В 1804 году он дважды поднимался на воздушном шаре на высоту 7000 метров, чтобы провести несколько замеров и опытов в условиях разреженного воздуха и полюбоваться невероятным пейзажем. Этот человек заслуживает особого упоминания в книге, посвященной Дальтону, поскольку он был одним из немногих ученых, способных возражать Дальтону по существу.
Главное слабое место атомной теории Дальтона — вопрос об объеме. Постулаты теории основаны на количественных законах — открытых самим Дальтоном и его коллегами,— но в них не учтены отношения объемов. Ученый утверждал — и всегда отстаивал эту точку зрения, — что если два разных газа имеют одну температуру, одно давление и, кроме того, занимают один объем, они обязательно будут иметь разное количество атомов. Однако Гей-Люссак в 1808 году открыл экспериментальным образом то, что он позже назвал законом объемных отношений.
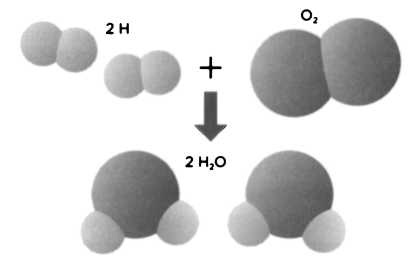
Самый известный результат его опытов с объемами газов — это опыт с водяными парами. Один объем кислорода вступает в реакцию с двумя объемами водорода, образуя два объема водяных паров:
O2 + 2Н2 → 2 Н2O (пар).
Эта реакция, подтвержденная опытом, не имеет смысла, если рассматривать ее в тесной связи с атомной теорией Дальтона. Для него газы не могли быть двухатомными, поскольку отталкивающие силы мешают атомам соединяться. Дальтон всегда отстаивал одноатомные соединения (O + Н → ОН), но эта реакция не соответствует результату опытов.
ЖОЗЕФ-ЛУИ ГЕЙ-ЛЮССАК
Гей-Люссак (1778-1850) был сыном прокурора Людовика XVI. Несмотря на полученное техническое образование — он учился на инженера, — ученый очень быстро увлекся химией и сформулировал два знаменитых газовых закона, носящих его имя. Кроме того, он изучал магнетизм, путешествуя по Европе в компании своего друга Александра фон Гумбольдта, а также электрофизику и электрохимию. Ученый открыл бор и калий, а также, параллельно с сэром Гемфри Дэви, йод и хлор. Его интересовали такие разные темы, как производство пушек и громоотвода, синтез едких кислот и определение сплава для монет. Отчасти его деятельность, как и большинства французских ученых того времени, касалась политической жизни. Гей-Люссак был членом палаты депутатов, Луи Филипп сделал его пэром Франции.

Закон Гей-Люссака
В 1805 году Гей-Люссак сформулировал первый закон, который устанавливал отношение между объемом и температурой определенного количества идеального газа при постоянном давлении:
V/T = постоянная.
Этот закон носит имя Шарля (или Шарля — Люссака), потому что около 1787 года его уже сформулировал Жак Шарль. Второй закон Гей-Люссака
Р/T = постоянная устанавливает отношение между давлением и температурой определенного объема. Этот закон, а также закон Бойля (PV = С) составляют группу законов идеальных газов.
Объемы реагирующих газов показывали, что две частицы водорода, соединяясь с одной частицей кислорода, образуют две частицы водяного пара (см. рисунок). Однако один атом кислорода не может дать две частицы воды, потому что каждая частица воды должна содержать по одному атому кислорода. Разумеется, если только атомы не могут делиться. После уточнения, сделанного Гей-Люссаком, мы получили исправленную атомную массу кислорода (равную 16 единицам по отношению к водороду). Гей-Люссак утверждал, что основной характеристикой элемента является объем, а вовсе не его атомная масса, как считал Дальтон. Поэтому при реакции лучше измерять объем газа, а не массу. Ошибка, допущенная Дальтоном в рассуждениях, заключалась в том, что он не различал атомы и молекулы.
В газообразном состоянии при равных температуре и давлении отношения между объемами образующегося газа выражаются простыми целыми числами.
Жозеф-Луи Гей-Люссак, закон отношения объемов
Однако Гей-Люссак не отрицал гипотезу Джона Дальтона; он открыто признавал полученные результаты искусными, и хотя в своих химических исследованиях он поменял местами по важности массу и объем, атомная теория, по сути, ему подходила. Она объясняла опыты не только Дальтона, но и других ученых, таких как Томсон и Волластон. В этом Гей-Люссак разошелся со своим учителем Бертолле, который верил не в атомы, а в частицы, опираясь на декартову идею об их бесконечной делимости. Гей-Люссак попытался соединить обе гипотезы в следующем утверждении: "Химическая реакция протекает с большей силой, если элементы находятся в простых отношениях, или в кратных отношениях" (1814).
Вопрос о том, какая из гипотез вернее — система "одного объема" или "двух объемов",— был решен только в 1860 году, когда состоялся Первый Международный химический конгресс в Карлсруэ (Германия). В те годы химики не знали, каким критериям следовать, потому что массу и объем связывали с плотностью. Томас Томсон, например, предложил поделить соединения на три группы в зависимости от плотности пара: плотность, равная их атомной массе, двойной атомной массе или четверной. Другие химики, например Волластон, работали не с атомной массой, объемом или плотностью пара, а с количественными эквивалентами, установленными в результате стехиометрических экспериментов. Были и такие (например, сэр Гемфри Дэви), кто работал только с пропорциями. Если сегодня проблема кажется нам легко решаемой, то это потому, что мы уже ясно различаем атом, молекулу и моль, или грамм- молекулу.
Прочитали книгу? Предлагаем вам поделится своим впечатлением! Ваш отзыв будет полезен читателям, которые еще только собираются познакомиться с произведением.
Оставить комментарий
-
 Ольга18 февраль 13:35
Измена .не прощу часть первая закончилась ,простите а где же вторая часть хотелось бы узнать
Измена. Не прощу - Анастасия Леманн
Ольга18 февраль 13:35
Измена .не прощу часть первая закончилась ,простите а где же вторая часть хотелось бы узнать
Измена. Не прощу - Анастасия Леманн
-
 Илья12 январь 15:30
Книга прекрасная особенно потому что Ее дали в полном виде а не в отрывке
Горький пепел - Ирина Котова
Илья12 январь 15:30
Книга прекрасная особенно потому что Ее дали в полном виде а не в отрывке
Горький пепел - Ирина Котова
-
 Гость Алексей04 январь 19:45
По фрагменту нечего комментировать.
Бригадный генерал. Плацдарм для одиночки - Макс Глебов
Гость Алексей04 январь 19:45
По фрагменту нечего комментировать.
Бригадный генерал. Плацдарм для одиночки - Макс Глебов
-
 Гость галина01 январь 18:22
Очень интересная книга. Читаю с удовольствием, не отрываясь. Спасибо! А где продолжение? Интересно же знать, а что дальше?
Чужой мир 3. Игры с хищниками - Альбер Торш
Гость галина01 январь 18:22
Очень интересная книга. Читаю с удовольствием, не отрываясь. Спасибо! А где продолжение? Интересно же знать, а что дальше?
Чужой мир 3. Игры с хищниками - Альбер Торш





