Читать книгу - "Абсолютный минимум. Как квантовая теория объясняет наш мир - Майкл Файер"
Аннотация к книге "Абсолютный минимум. Как квантовая теория объясняет наш мир - Майкл Файер", которую можно читать онлайн бесплатно без регистрации
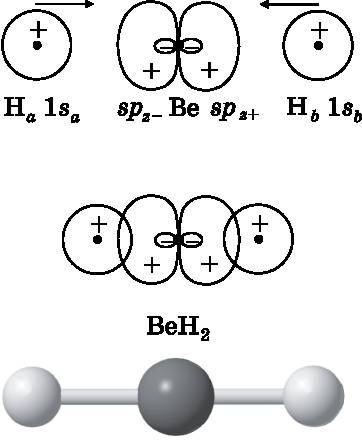
Рис. 14.6. Вверху: два атома H приближаются к атому Be. В середине: 1s-орбитали атома H образуют парные электронные связи с двумя sp-гибридизированными орбиталями атома Be, в результате чего формируется линейная молекула BeH 2 , изображённая внизу в виде шаростержневой модели
Молекула BeH2 имеет шесть электронов: две пары связывающих электронов и два электрона на 1s-орбитали атома Be. Важно отметить, что все эти электроны являются волнами амплитуды вероятности, которые охватывают всю молекулу. Когда говорится, что 1sa-электрон создаёт связывающую электронную пару с spz−-электроном, — это «бухгалтерская» условность. Все электроны свободно перемещаются по целой молекуле. Однако распределения вероятности для электронов таковы, что в любой данный момент электронная плотность, связанная с атомом Be и одним из атомов H, соответствует одной связи, а электронная плотность, связанная с атомом Be и другим атомом H, соответствует другой связи.
Как отмечалось при обсуждении рис. 14.3, молекула BH3 треугольная с углами 120° между связями. Атом бора имеет три валентных электрона: два на 2s-орбитали и один на 2p-орбитали. Для образования трёх электронных пар, совместно используемых с тремя атомами водорода, атому бора требуется три неспаренных электрона. В верхней части рис. 14.7 показано, что атом B поднимает один электрон с 2s-орбитали на 2p-орбиталь, чтобы получить три неспаренных электрона. Если молекула лежит в плоскости xy, то задействованными в образовании связей 2p-орбиталями будут 2px и 2py. Для того чтобы молекула BH3 имела форму равностороннего треугольника, три атомные орбитали бора гибридизируются и дают три гибридные атомные орбитали: spa2, spb2 и spc2. Обозначение sp2 указывает на то, что гибридные орбитали состоят из одной s-орбитали и двух разных p-орбиталей. Мы начинаем с трёх разных орбиталей: 2s, 2px и 2py. Орбитали никогда не возникают и не пропадают, поэтому получаются три различные гибридные орбитали. Они показаны в средней части рис. 14.7. Каждая орбиталь имеет положительный и отрицательный лепестки. Соседние лепестки расположены под углом 120° по отношению друг к другу. Каждая из орбиталей содержит по одному из трёх неспаренных валентных электронов атома бора.
В нижней части рис. 14.7 показано связывание атома B с тремя атомами H. Каждый атом H имеет единственный 1s-электрон. 1s-орбиталь атома H объединяется с sp2-орбиталью атома B и образует связывающую молекулярную орбиталь. В результате появляются связывающие пары электронов. Каждая из этих связей между атомами B и H является σ-связью, поскольку имеется ненулевая электронная плотность на прямой, соединяющей ядра. Модель молекулы BH3 представлена на рис. 14.3.
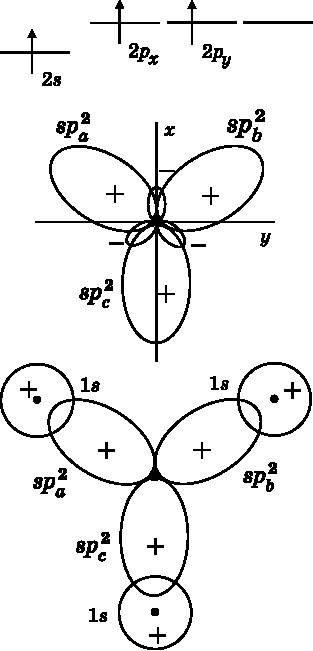
Рис. 14.7.Вверху: валентные электроны бора, один из которых поднят на 2p — орбиталь. Посередине: 2s-, 2px- и 2py-орбитали бора объединяются тремя способами и образуют три гибридные атомные орбитали: spa2, spb2и spc2. Угол между лепестками составляет 120°. Внизу: три гибридные орбитали атома бора образуют связи с 1s-орбиталями трёх атомов H
В молекуле метана углерод создаёт четыре связи с четырьмя атомами водорода. Как говорилось выше и показано на рис. 14.1 и 14.2, молекула метана имеет форму тетраэдра. На рис. 14.4 видно, что для создания четырёх валентных связей, совместно использующих электронные пары, углерод поднимает один из своих 2s-электронов на 2p-орбиталь. В результате у него появляется четыре неспаренных электрона на 2s-, 2px-, 2py- и 2pz-орбиталях. При обсуждении рис. 14.4 уже довольно подробно объяснялось, что эти четыре атомные орбитали не могут породить одинаковые связи с четырьмя атомами водорода и привести к появлению тетраэдрической молекулы. Поэтому 2s-, 2px-, 2py- и 2pz-орбитали объединяются в четырёх различных комбинациях и образуют четыре гибридные атомные орбитали: spa3, spb3, spc3 и spd3. Обозначение sp3 указывает на то, что каждая из четырёх гибридных атомных орбиталей является комбинацией s-орбитали и трёх различных p-орбиталей.
На рис. 14.8 показано, что четыре sp3-орбитали перекрываются с четырьмя 1s-орбиталями атомов водорода. Изображены только положительные лепестки sp3-орбиталей. Каждая из них имеет небольшой отрицательный лепесток, направленный в сторону, противоположную положительному лепестку, аналогично тому, как это показано на среднем изображении рис. 14.7 для sp2-орбиталей. Орбитали, изображённые штриховыми кривыми, лежат в плоскости страницы. Орбиталь, показанная сплошной кривой, выступает под углом над плоскостью страницы, а орбиталь, показанная штрихпунктирной линией, уходит под углом за плоскость страницы. Угол между любой парой sp3-лепестков составляет 109,5°, что обеспечивает правильную тетраэдрическую форму, о которой говорилось при обсуждении рис. 14.1 и 14.2.
На рис. 14.2 изображены молекулы метана, аммиака и воды. Как уже говорилось, все они имеют тетраэдрическую форму, если включить в рассмотрение неподелённые пары, но молекулы аммиака и воды имеют форму не совсем правильных тетраэдров. Подобно метану, аммиак и вода также используют sp3-гибридизацию для образования связей. Азот в аммиаке NH3 имеет пять валентных электронов. Два из них образуют неподелённую пару. Она не участвует в образовании химических связей. Азот использует три из своих четырёх гибридных sp3-орбиталей для соединения с тремя атомами H. Четвёртая sp3-орбиталь содержит неподелённую пару.
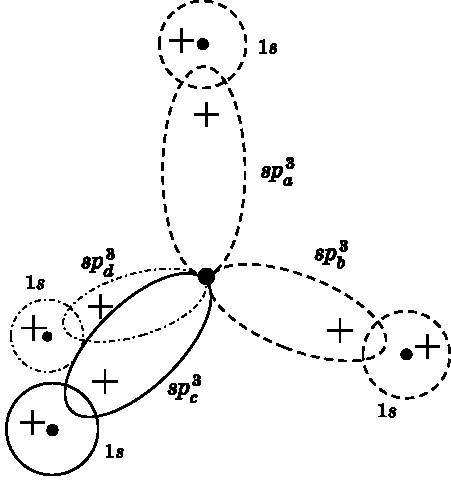
Рис. 14.8. Четыре sp 3 -гибридизированные атомные орбитали углерода и четыре 1s-орбитали водорода в молекуле метана, где атом углерода соединён с четырьмя атомами водорода. Штриховые орбитали лежат в плоскости страницы. Сплошная орбиталь выступает над этой плоскостью. Штрихпунктирная орбиталь лежит за плоскостью страницы. Показаны только положительные лепестки гибридных sp 3 -орбиталей. Четыре гибридные sp 3 -орбитали образуют правильный тетраэдр
Прочитали книгу? Предлагаем вам поделится своим впечатлением! Ваш отзыв будет полезен читателям, которые еще только собираются познакомиться с произведением.
Оставить комментарий
-
 Ольга18 февраль 13:35
Измена .не прощу часть первая закончилась ,простите а где же вторая часть хотелось бы узнать
Измена. Не прощу - Анастасия Леманн
Ольга18 февраль 13:35
Измена .не прощу часть первая закончилась ,простите а где же вторая часть хотелось бы узнать
Измена. Не прощу - Анастасия Леманн
-
 Илья12 январь 15:30
Книга прекрасная особенно потому что Ее дали в полном виде а не в отрывке
Горький пепел - Ирина Котова
Илья12 январь 15:30
Книга прекрасная особенно потому что Ее дали в полном виде а не в отрывке
Горький пепел - Ирина Котова
-
 Гость Алексей04 январь 19:45
По фрагменту нечего комментировать.
Бригадный генерал. Плацдарм для одиночки - Макс Глебов
Гость Алексей04 январь 19:45
По фрагменту нечего комментировать.
Бригадный генерал. Плацдарм для одиночки - Макс Глебов
-
 Гость галина01 январь 18:22
Очень интересная книга. Читаю с удовольствием, не отрываясь. Спасибо! А где продолжение? Интересно же знать, а что дальше?
Чужой мир 3. Игры с хищниками - Альбер Торш
Гость галина01 январь 18:22
Очень интересная книга. Читаю с удовольствием, не отрываясь. Спасибо! А где продолжение? Интересно же знать, а что дальше?
Чужой мир 3. Игры с хищниками - Альбер Торш





