Читать книгу - "Вселенная внутри вас - Брайан Клег"
Аннотация к книге "Вселенная внутри вас - Брайан Клег", которую можно читать онлайн бесплатно без регистрации
Еще одна чрезвычайно важная черта углекислого газа заключается в том, что он является пищей для растений. Как уже было сказано, жизненный цикл обитателей Земли базируется на растениях. В них нуждаются даже плотоядные животные, поедающие других животных, так как в конце пищевой цепи вы непременно обнаружите растение. Растения поглощают углекислый газ из воздуха, используя углерод в процессе фотосинтеза и вырабатывая в качестве побочного продукта кислород, которым мы дышим.
Еще одно свойство углекислого газа, на этот раз не столь серьезное, было обнаружено сравнительно давно. В 1756 году шотландский врач Джозеф Блэк впервые получил чистую двуокись углерода. Спустя 11 лет Джозеф Пристли, открывший впоследствии кислород, начал изучать свойства этого газа в пивоварне Лидса. Один из экспериментов заключался в пропускании пузырьков углекислого газа через воду. Часть газа при этом растворялась, придавая обычной воде привкус альпийских минеральных вод.
Пристли совсем забыл об этом опыте и вспомнил о нем лишь в 1772 году на ужине у герцога Нортумберлендского в Лондоне. Развлекая гостей, хозяин предложил им морскую воду, опресненную методом дистилляции. Гости сочли ее слишком безвкусной, и тогда Пристли объявил, что знает, как улучшить вкус. На следующий день он приготовил содовую. В то время Пристли получал углекислый газ в ходе реакции серной кислоты с мелом, весьма схожей с той, что происходит в желудке при приеме таблетки антацида. Впоследствии его выгнали из пивоварни за то, что он испортил целую партию пива, пытаясь растворить двуокись углерода в эфире. К сожалению, Пристли так и не поставил производство содовой воды на коммерческую основу. Спустя несколько лет этим изобретением воспользовался швейцарец Иоганн Швеппе.
Должно быть, в школе химия ассоциировалась у вас с громоздкой периодической таблицей элементов. Так вот, эта таблица позволяет предсказать, как поведет себя кислота в вашем желудке, если выпить таблетку антацида. Когда Дмитрий Иванович Менделеев представил ее научной общественности, она стала настоящим прорывом в химии. Русский ученый был не единственным и далеко не первым, кто пытался обнаружить какой-то порядок в многообразии различных элементов, из которых состоит окружающий мир. Но он оказался самым упорным и настойчивым в раскладывании пасьянса из карточек с названиями элементов и в итоге сумел расположить их так, чтобы придать смысл всей картине.
Принципы, лежащие в основе периодической таблицы, достаточно просты. В ней есть несколько рядов, в которых элементы располагаются друг за другом слева направо в порядке возрастания массы. Эти ряды разделяются на колонки, в которых объединяются элементы со схожими свойствами. Сам того не осознавая, Менделеев поместил в каждую колонку элементы, у которых внешний слой имел одинаковое количество электронов (или одинаковое количество недостающих электронов). Поскольку именно эти электроны определяют характер связи атома с другими элементами, от них зависят и химические свойства.
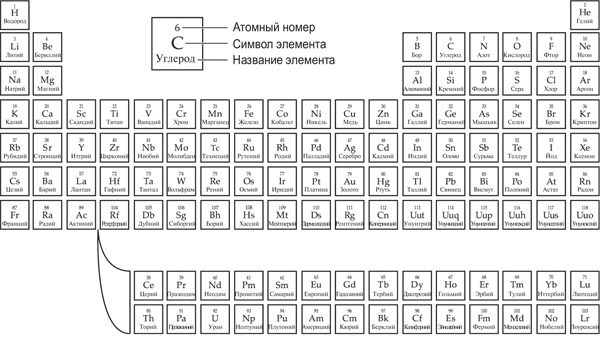
Периодическая таблица элементов
Данный подход доказал свою правоту, когда Менделеев предсказал существование новых элементов, которые до этого были неизвестны. В таблице были пробелы, и Менделеев посчитал, что их должны занять атомы, обладающие схожими свойствами с уже известными элементами данной группы. Так, например, под кремнием оказалось пустое место, и Менделеев назвал недостающий элемент экакремнием (от санскр. эка – один).
Вскоре действительно был открыт элемент, заполнивший пустое место в таблице. Его назвали германием. У этого элемента есть ряд схожих черт с кремнием (оба в настоящее время используются для изготовления транзисторов и других электронных устройств), и его химические свойства точно совпали с предсказанными Менделеевым.
Периодическая таблица вплоть до нынешнего дня используется для того, чтобы определить химические свойства новых элементов, хотя и не все они так предсказуемы, как у германия. Взять хотя бы элемент с порядковым номером 114. К моменту написания книги он все еще не имеет настоящего названия[1]и проходит под «кличкой» унунквадий (от лат. unum-unum-quartum – один-один-четыре). К настоящему времени самый тяжелый элемент, имеющий название, – это коперниций (порядковый номер 112).
Сверхтяжелый элемент № 114 никогда не попадет в ваш желудок. Он не встречается в природе. Самым тяжелым из природных элементов является уран (порядковый номер 92). Все более тяжелые элементы получены искусственно – либо в ядерных реакторах, либо на ускорителях частиц. Для создания сверхтяжелых элементов требуются специальные условия, потому что сила, удерживающая ядро атома (сильное взаимодействие), должна преодолевать силу отталкивания, возникающую между большим количеством положительно заряженных протонов.
Сильное взаимодействие имеет один существенный недостаток: оно проявляется лишь на очень-очень малом расстоянии. Таким образом, 92 протона в атоме урана (порядковый номер элемента показывает, сколько протонов находится в ядре и сколько электронов образуют его оболочку) – это предел, при превышении которого сильное взаимодействие уже не может удержать частицы ядра вместе. Все более тяжелые элементы, как правило, очень нестабильны.
Время жизни большинства сверхтяжелых элементов составляет тысячные или даже миллионные доли секунды. Затем они распадаются. Однако унунквадий находится на так называемом «островке стабильности», то есть в той части таблицы, где атомы проявляют способность сохраняться несколько дольше, поскольку количество частиц в ядре позволяет упаковать их в более или менее стабильную форму. Изотоп элемента № 114, имеющий атомную массу 289, способен прожить несколько секунд.
Изотопы, как уже говорилось выше, – это варианты одного и того же элемента, отличающиеся друг от друга количеством нейтронов в ядре. Ядро самого простого из всех атомов – водорода – состоит из одного-единственного протона. Если добавить к нему нейтрон, то полученный элемент по-прежнему будет проявлять все химические свойства водорода, так как у него только один электрон, а именно от него зависит, как атом будет вести себя с другими веществами. Однако благодаря лишнему нейтрону ядро станет тяжелее и будет по-другому вести себя в ядерных реакциях. Вместо водорода мы получили его изотоп – дейтерий.
Поскольку практически вся масса атома сосредоточена в ядре, атомная масса элемента представляет собой сумму количества протонов и нейтронов. Поэтому в ядре изотопа унунквадия с атомной массой 289 содержится 175 нейтронов (289–114 = 175).
Элемент № 114 был открыт в 1998 году в Объединенном институте ядерных исследований в Дубне (Россия). В первом эксперименте был получен всего один атом этого элемента, и, хотя с тех пор был открыт целый ряд его изотопов, каждый раз речь шла всего о нескольких атомах. С учетом их малого количества и того обстоятельства, что существуют они всего несколько секунд, мы пока не имеем представления о том, как выглядит унунквадий. Предполагается, что он должен быть серебристо-серым металлом, как и большинство элементов из этой области периодической таблицы.
Прочитали книгу? Предлагаем вам поделится своим впечатлением! Ваш отзыв будет полезен читателям, которые еще только собираются познакомиться с произведением.
Оставить комментарий
-
 Ольга18 февраль 13:35
Измена .не прощу часть первая закончилась ,простите а где же вторая часть хотелось бы узнать
Измена. Не прощу - Анастасия Леманн
Ольга18 февраль 13:35
Измена .не прощу часть первая закончилась ,простите а где же вторая часть хотелось бы узнать
Измена. Не прощу - Анастасия Леманн
-
 Илья12 январь 15:30
Книга прекрасная особенно потому что Ее дали в полном виде а не в отрывке
Горький пепел - Ирина Котова
Илья12 январь 15:30
Книга прекрасная особенно потому что Ее дали в полном виде а не в отрывке
Горький пепел - Ирина Котова
-
 Гость Алексей04 январь 19:45
По фрагменту нечего комментировать.
Бригадный генерал. Плацдарм для одиночки - Макс Глебов
Гость Алексей04 январь 19:45
По фрагменту нечего комментировать.
Бригадный генерал. Плацдарм для одиночки - Макс Глебов
-
 Гость галина01 январь 18:22
Очень интересная книга. Читаю с удовольствием, не отрываясь. Спасибо! А где продолжение? Интересно же знать, а что дальше?
Чужой мир 3. Игры с хищниками - Альбер Торш
Гость галина01 январь 18:22
Очень интересная книга. Читаю с удовольствием, не отрываясь. Спасибо! А где продолжение? Интересно же знать, а что дальше?
Чужой мир 3. Игры с хищниками - Альбер Торш