Читать книгу - "Популярная физика. От архимедова рычага до квантовой теории - Айзек Азимов"
Аннотация к книге "Популярная физика. От архимедова рычага до квантовой теории - Айзек Азимов", которую можно читать онлайн бесплатно без регистрации
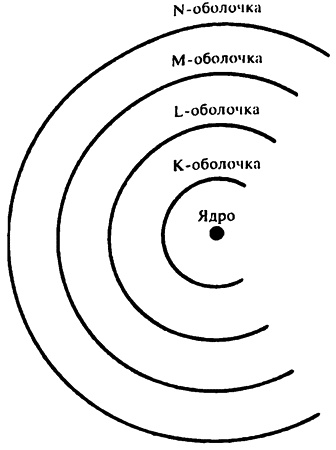
Электронные оболочки
Одной из причин является то, что любая химическая реакция включает в себя в том числе и взаимодействие электронов внутри атомов. Например, хлорид натрия состоит из ионов натрия и газообразного хлора. В процессе реакции атом натрия теряет один электрон и становится положительно заряженным ионом Na+, а атом хлора присоединяет один электрон и становится отрицательно заряженным ионом Cl–.
Возможно, благородные газы не вступают в химические реакции потому, что уже обладают жесткой электронной структурой, а присоединение или потеря электронов приведет к потере этой структурной устойчивости.
Логично предположить, что эта устойчивость достигается полным заполнением одной из электронных оболочек.
Например, атомное число гелия равно 2, и гелий является благородным газом. Если атом гелия содержит два электрона, значит, ему необходимы лишь два электрона для полного заполнения внутренней электронной оболочки К. Атом следующего благородного газа — неона — в нейтральном состоянии обладает 10 электронами, 2 из которых заполняют оболочку К, а оставшиеся 8 — оболочку L. В каждом атоме аргона (атомное число 18) уже по 18 электронов, 2 из которых заполняют оболочку К, еще 8 — L, а оставшиеся 8 — оболочку М. В табл. 4 показано, как электроны по электронным оболочкам распределены у первых 20 элементов. (У элементов с большим атомным числом распределение становится уже более сложным, см. гл. 5.)
Вскоре после опубликования Мозли своих работ были сделаны первые попытки рассмотреть химические реакции с точки зрения распределения электронов по электронным оболочкам. Успехом увенчались попытки работавших независимо друг от друга американских химиков Гилберта Ньютона Льюиса (1875–1946) и Ирвинга Ленгмюра (1881–1957). Суть их теории вкратце заключается в том, что в процессе любой химической реакции элементы стараются потерять или присоединить электроны, чтобы перейти в такое же, как и у благородных газов, устойчивое состояние.
Так, натрий с распределением электронов по оболочкам 2/8/1 проявляет тенденцию отдать один электрон, чтобы превратиться в ион натрия (Na+) с распределением электронов 2/8, как у атома неона. Конечно же ион натрия не превращается в атом неона, так как заряд ядра (уникальный для каждого элемента) иона натрия остается +11, а заряд ядра атома неона равняется +10. То же можно сказать и о хлоре. Атом хлора с распределением электронов 2/8/7 проявляет тенденцию присоединить еще один электрон и стать ионом хлора (Cl–) с распределением электронов 2/8/8, как у атома аргона.
Легкость, с которой натрий и хлор реагируют друг с другом, объясняется их обоюдным желанием отдать и присоединить электрон. Атом хлора присоединяет «лишний» электрон натрия, после чего элементы превращаются в ионы с разноименным зарядом и притягиваются друг к другу.
Точно так же кальций (2/8/8/2) легко отдает 2 электрона и становится ионом кальция (Са++) с распределением электронов по аргону (2/8/8), а кислород (2/6) присоединяет эти 2 электрона и становится оксид-ионом (О––) с распределением по неону (2/8). Вместе эти ионы образуют оксид кальция (СаО).
Или кальций может отдать один электрон одному атому хлора, а второй — другому, и тогда образуется хлорид кальция (СаСl2), то есть один грамм-атом хлора соединяется с половиной грамм-атома кальция. Таким образом, с точки зрения электронов можно объяснить существование эквивалентных масс.
Таблица 4.
РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ
| Элемент | Атомное число | Число электронов в оболочке | |||
| К | L | М | N | ||
| Водород | 1 | 1 | _ | _ | _ |
| Гелий | 2 | 2 | — | — | _ |
| Литий | 3 | 2 | 1 | — | _ |
| Бериллий | 4 | 2 | 2 | — | — |
| Бор | 5 | 2 | 3 | — | — |
| Углерод | 6 | 2 | 4 | — | — |
| Азот | 7 | 2 | 5 | _ | _ |
| Кислород | 8 | 2 | 6 | — | — |
| Фтор | 9 | 2 | 7 | — | — |
| Неон | 10 | 2 | 8 | — | — |
| Натрий | 11 | 2 | 8 | 1 | — |
| Магний | 12 | 2 | 8 | 2 | — |
| Алюминий | 13 | 2 | 8 | 3 | — |
| Кремний | 14 | 2 | 8 | 4 | — |
| Фосфор | 15 | 2 | 8 | 5 | — |
| Сера | 16 | 2 | 8 | 6 | — |
| Хлор | 17 | 2 | 8 | 7 | — |
| Аргон | 18 | 2 | 8 | 8 | — |
| Калий | 19 | 2 | 8 | 8 | 1 |
| Кальций | 20 | 2 | 8 | 8 | 2 |
Но как же тогда образуется молекула хлора? Ведь атом хлора проявляет тенденцию присоединить, но никак не отдать электрон. Льюис и Ленгмюр предположили, что если два атома хлора находятся в непосредственной близости, то их внешние электронные оболочки соприкасаются и заполняются электронами друг друга, и общее число электронов каждого атома становится таким же, как и аргона, — 2/8/8.
Прочитали книгу? Предлагаем вам поделится своим впечатлением! Ваш отзыв будет полезен читателям, которые еще только собираются познакомиться с произведением.
Оставить комментарий
-
 Ольга18 февраль 13:35
Измена .не прощу часть первая закончилась ,простите а где же вторая часть хотелось бы узнать
Измена. Не прощу - Анастасия Леманн
Ольга18 февраль 13:35
Измена .не прощу часть первая закончилась ,простите а где же вторая часть хотелось бы узнать
Измена. Не прощу - Анастасия Леманн
-
 Илья12 январь 15:30
Книга прекрасная особенно потому что Ее дали в полном виде а не в отрывке
Горький пепел - Ирина Котова
Илья12 январь 15:30
Книга прекрасная особенно потому что Ее дали в полном виде а не в отрывке
Горький пепел - Ирина Котова
-
 Гость Алексей04 январь 19:45
По фрагменту нечего комментировать.
Бригадный генерал. Плацдарм для одиночки - Макс Глебов
Гость Алексей04 январь 19:45
По фрагменту нечего комментировать.
Бригадный генерал. Плацдарм для одиночки - Макс Глебов
-
 Гость галина01 январь 18:22
Очень интересная книга. Читаю с удовольствием, не отрываясь. Спасибо! А где продолжение? Интересно же знать, а что дальше?
Чужой мир 3. Игры с хищниками - Альбер Торш
Гость галина01 январь 18:22
Очень интересная книга. Читаю с удовольствием, не отрываясь. Спасибо! А где продолжение? Интересно же знать, а что дальше?
Чужой мир 3. Игры с хищниками - Альбер Торш





